2017 yılında Stürner ve arkadaşları tarafından Almanya’da, standartlaştırılmış Boswellia serrata ekstresinin oral yoldan uygulanmasının güvenli olup olmadığını ve tekrarlayan-düzelen multipl skleroz (RRMS) hastalarında hastalık aktivitesini azaltıp azaltmadığını araştırmak amacı ile yapılan çalışmada Boswellia serrata ekstresinin, aylık kontrast arttırıcı lezyonların ortalama sayısını 5-8. aylarda 1,00'den 0,50’e düşürerek önemli ölçüde azalttığı ve parankimal beyin hacmi değişikliği ile değerlendirildiğinde önemli ölçüde daha az beyin atrofisi gözlenmiştir (100).
Alpinia Laudanum Fitofarmasötik Bilimler Enstitüsü (Walenstadt, İsviçre) tarafından iki Alman yüksek öğretim akademik yüksek lisans kurumunda üretilen, oral yol ile kullanılabilen bir Boswellia serrata ekstresi ile 21 Eylül 2011 ile 7 Mart 2017 tarihleri arasında iki merkezli, faz IIa, açık etiketli, başlangıç-tedavi denemesi gerçekleştirilmiştir. Güvenlik verilerine ve hastaların taleplerine dayanarak, ekstrenin 36 aya kadar alınması seçeneğini de içerecek şekilde çalışmanın uzatılması için başvuruda bulunulmuş ve onaylanmıştır. Güvenliği ve etkinliği izlemek üzere üç uluslararası MS uzmanından oluşan bağımsız bir veri güvenliği izleme kurulu atanmıştır.
Uygun hastalar, McDonald kriterlerine göre tekrarlayan-düzelen multipl skleroz (RRMS) veya klinik olarak izole sendrom tanısı alan, Genişletilmiş Engellilik Durum Ölçeği'nde (EDSS) 0-5,5 başlangıç sakatlık puanına ve ayda ortalama en az 0,5 gadolinyum arttırıcı MRI lezyonu (kontrast arttırıcı lezyonlar, CEL), yani tedavi öncesi başlangıç dönemi sırasında dört MRI taramasında en az iki CEL lezyonu olan, 18 ila 55 yaşları arasındaki erkek veya kadındır.
Çalışma tasarımı şekil 20’de sunulmaktadır. Çalışma dört aşamadan oluşmuştur: başlangıç gözlemi (1. aşama), bireysel doz bulma aşaması (2. aşama), tedavi aşaması (3. aşama) ve uzatma (4. aşama). Onay verdikten sonra hastalar, kontrastlı beyin MRI taramaları ve klinik puanlama için ilgili çalışma merkezinde aylık ziyaretlerle 3 aylık bir temel gözlem aşamasına (aşama 1) girmişler. Boswellia serrata ekstresi, 400 mg içeren kapsüller halinde sağlanmıştır. İlk 8 hafta boyunca hastalar iki bölümden oluşan bireyselleştirilmiş doz bulma aşamasına (2. aşama) dahil edilmişlerdir. 1. aşamada, İlk 28 gün her ikinci veya üçüncü günde bir kapsül ekleyerek iyi tolere edilen maksimum doza veya maksimum 4800 mg/gün'e (hangisi önce meydana gelirse), yani günde üç kez 1600 mg'a kadar titre etmek için 400 mg'a kadar Boswellia serrata ekstresi kapsülleri kullanılmıştır.

Bireysel olarak iyi tolere edilen maksimum doz belirlendikten sonra hastalar, stabilizasyon ve tolere edilebilirliğin değerlendirilmesi için 28 gün daha (bölüm 2) bu doza devam etmiştir. Bunu, bu dozda 6 aylık sürekli tedavi izlemiştir (aşama 3). Deneye devam etmek için minimum tolere edilen doz olan 2400 mg/gün zorunlu tutulmuştur. Çalışma sırasında hastalığın nüksetmesi durumunda hastalara, deneyi sonlandırıp standart tedaviye dönme seçeneği sunulmuştur. Hastalar 8. aya kadar çalışma merkezinde değerlendirme ve MR için ayda bir, daha sonra 12. ayda tekrar ve sonrasında üçer aylık aralıklarla görülmüştür.
Birincil sonuç ölçütleri, kontrast arttırıcı lezyonların (CEL) ortalama sayısındaki ve başlangıç ile tedavi aşamaları arasındaki lezyon hacmindeki değişikliklerdir. İkincil sonuç ölçütleri ise yeni aktif lezyonların sayısı (CEL'ler, T2 lezyonları), beyin atrofisi miktarı (parenkimal beyin hacmi değişikliği, PBVC) ve yıl başına doğrulanan nüks sayısını tanımlayan yıllık nüks oranıdır (ARR).
Gözlem aşamasında 80 hasta gözlemlenmiş olup, 80 hastanın 38’i çalışmaya dahil edilmiştir. 10 hasta (%26) birincil son noktaya ulaşamamıştır: 6 hasta (%16) doz uygulama aşamasında çalışmayı bırakmış, 4 hasta ise (%10) 3-6. aylarda çalışmayı bırakmıştır. Çalışmayı bırakma nedenleri sorulduğunda, 4 hasta zaman alıcı çalışma protokolüne uyamadığını belirtmiş; 4 hasta hastalığın tekrarlaması ve onaylı ilaç tedavisine başlama kararı nedeniyle çalışmayı bıraktığını (ikisi doz aşamasında, ikisi 4. ayda ve ayda) belirtmiştir. Bir hasta kapsülleri düzenli olarak kullanamamış veya tat ile ilgili problem yaşadığından kullanamamış ve bir hasta da devam eden ürtiker nedeniyle tedaviyi erken bırakmıştır.
34 hasta, tüm deneme boyunca Boswellia serrata ekstresinin maksimum protokol dozu olan 4800 mg/gün'ü (n=34/38; %89,5) tolere etmiştir. 3 hastada dozun günde 3600 mg’da tutulması gerekmiş ve bir hasta yalnızca minimum 2400 mg/gün dozu tolere etmiştir. 8. ayda hastaların çoğunluğu (26/28; %92,8) hâlâ günlük maksimum 4800 mg dozunu almaya devam etmişlerdir.
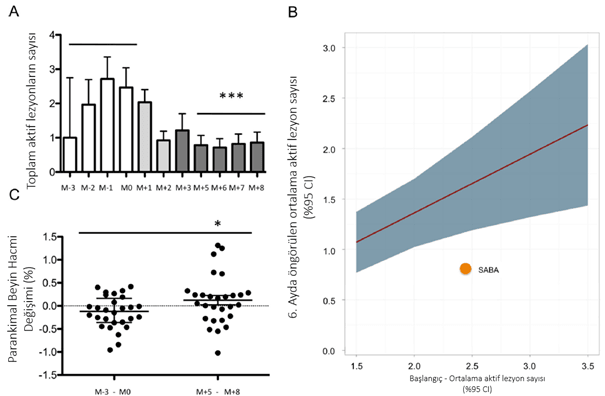
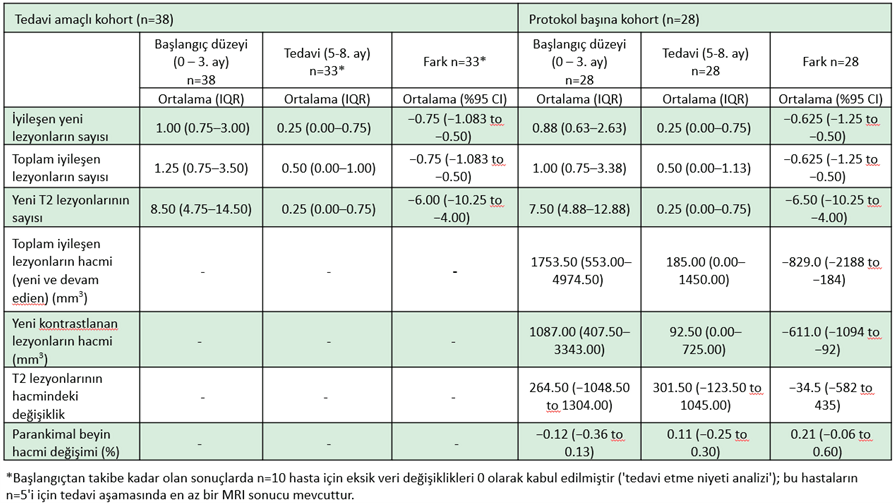
Birincil sonuç, toplam CEL sayısı ve CEL hacmi için karşılanmıştır (tablo 15 ve şekil 21A). Toplam CEL sayısı, tedavi süresi boyunca (5-8 ay; P<0,0001) başlangıç medyanı 1,0'dan (IQR 0,75–3,38) 0,5'e (IQR 0,00–1,13) düşerek önemli ölçüde azalmıştır. CEL'lerin hacmi, başlangıç aşamasında (-3 aydan 0'a kadar) ortalama 1753,5 mm3'ten (IQR 553–4974,5 mm3) 185 mm3'e (IQR 0,00–1450,00 mm3; n=28; P=0,0481) düşerek önemli ölçüde azalmıştır. Tedavi etme amacı (ITT) analizi de anlamlı sonuçlar vermiştir (tablo 15). Her iki analiz de başlangıç ve tedavi aşaması arasında toplam CEL sayısında %60'tan fazla azalma olduğunu göstermiştir.
RRMS'deki faz II ve III denemelerinden elde edilen verilere dayalı bir öngörü modeli kullanıldığında, bu etki, %95 güven aralığının altındaki ortalama etkiye (RTTME) gerileme nedeniyle CEL'lerdeki azalmayı aşmaktadır (Tablo 21B). Sunulan meta-analitik modelin öngördüğü gibi, RTTME, hasta grubumuzdaki yeni CEL sayısının başlangıç ortalama değeri olan 2,5’tan 6. ayda 1,6’ya düşüşünü açıklamaktadır; sayı aslında azalmıştır. ITT analizinde ise ortalama 0,8 CEL'e ulaşılmıştır.
Ek olarak, dört temel tarama sırasında beyin hacminde ılımlı bir azalma gözlemlenmiş (PBVC -0,12, IQR -%0,36 ila %0,13), tedavi sırasında ise beyin hacminde küçük bir artış gözlemlenmiştir (PBVC 0,11, IQR -%0,06 ila 0,6) %, tablo 15 ve şekil 21C; P=0,0081).
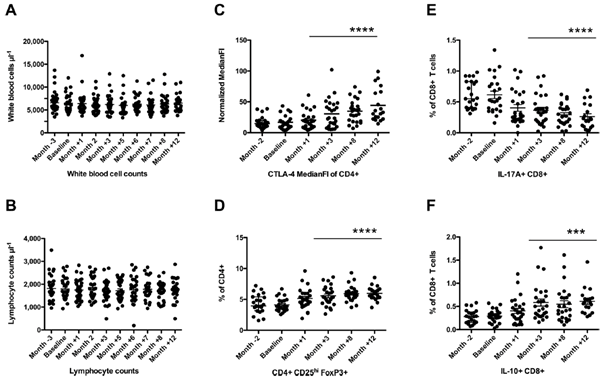
Hasta grubunda laboratuvar parametreleri ve çoğu lenfosit alt popülasyonu, Boswellia serrata ekstresi tedavisinin ilk yılı boyunca hiçbir değişiklik göstermemiştir (şekil 22A, B). Bununla birlikte, CD3+ T hücresi bölmesinde değişiklikler gözlemlenmiştir (şekil 22C–F): CD4+ T hücreleri, CTLA-4 yüzey ekspresyonunda bir artış göstermiş ve CD4+ CD25hi FoxP3+ T hücrelerinin sıklığı, tedavi sırasında önemli ölçüde artmıştır.
Sitokin üreten CD8+ T hücrelerinin sıklığı analiz edilirken, IL-17A üreten CD8+ T hücrelerinin azaldığı, IL-10 üreten CD8+ T hücrelerinin sıklığının ise tedavi sırasında eş zamanlı olarak arttığı bulunmuştur (tümü P<0,001). Bu parametrelerden yalnızca CD4+ CD25hi FoxP3+ T hücrelerinin frekansı, birincil sonuç parametresi, yani CEL sayısı (Spearman korelasyon katsayısı -0,46, P=0,0281) ile anlamlı, negatif bir korelasyon göstermiştir (100).